A Agência Nacional de Vigilância Sanitária (Anvisa) pode autorizar o uso emergencial e temporário de vacinas contra a covid-19 no País. A medida permite acelerar a entrada de um imunizante no País mesmo que os estudos ainda não estejam concluídos. O órgão divulgou nesta quarta-feira, 2, um guia sobre os requisitos mínimos para conceder essa autorização, que só valerá para aplicação em públicos restritos, como idosos ou profissionais de saúde.

"Se observarmos, pelos dados do momento, que para população específica, como idosos ou profissionais de saúde, existe risco-benefício claro, que seja positivo, a autorização de uso emergencial se justifica", disse à imprensa o gerente-geral de Medicamentos e Produtos Biológicos da Anvisa, Gustavo Mendes.
A agência pondera que essa autorização emergencial não substituirá a necessidade de a fabricante obter posteriormente o registro do produto. Só após este aval, que exige estudos clínicos finalizados, a vacina poderá ser entregue a toda a população ou vendido para a rede privada. Com a permissão temporária, o imunizante só poderá ser distribuído via rede pública, com foco específico: imunizar médicos que atuam em UTIs de pacientes de covid-19, por exemplo.
“É importante ressaltar que a autorização de uso emergencial e temporária de uma vacina experimental contra a covid-19 é restrita a um público previamente definido. Essa autorização não substitui o registro sanitário no Brasil. Somente as vacinas com registro sanitário concedido pela Anvisa poderão ser disponibilizadas e comercializadas para toda a população”, afirma nota da agência.
Mendes afirmou ainda que o rótulo da vacina liberada desta forma deverá indicar que a destinação é para "uso emergencial" . "A autorização pode ser interrompida e retirada a qualquer momento", afirmou ele. O gerente de Medicamentos explicou que a autorização excepcional para uso de produtos já é prevista em resoluções da Anvisa, mas agora a agência definiu regras mais claras sobre a vacina contra a covid-19.
A Anvisa deve decidir sobre cada pedido durante reuniões da Diretoria Colegiada, que é formada por cinco integrantes. A solicitação de uso emergencial pode ser feito à agência por empresas desenvolvedoras de vacina contra a covid-19 e, segundo as regras definidas pela agência, ensaios clínicos da fase 3 da vacina - a última etapa da pesquisa - devem estar em andamento no Brasil.
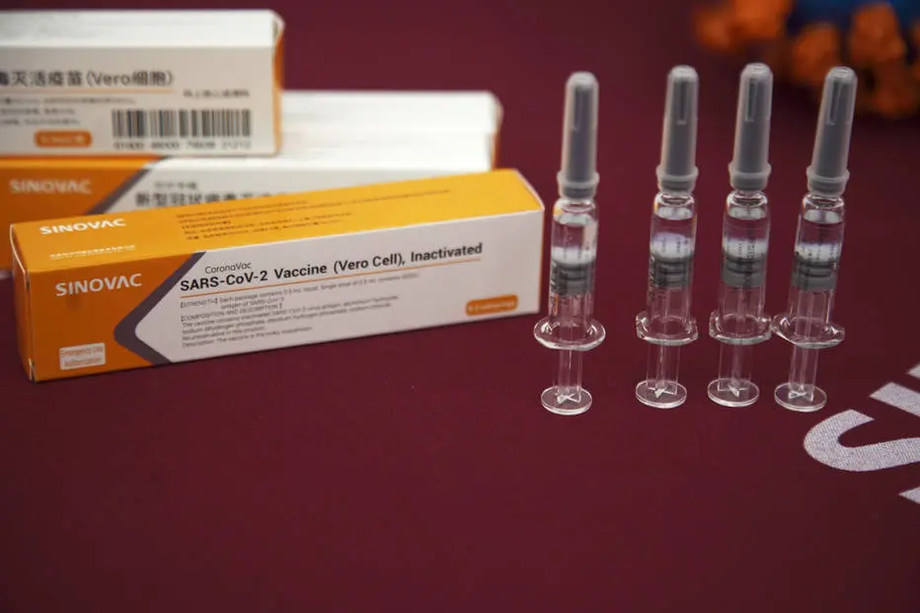
Há 4 vacinas com testes de fase 3 em andamento no País: o modelo desenvolvido pela farmacêutica AstraZeneca em parceria com a Universidade Oxford, a da chinesa Sinovac em parceria com o Instituto Butantã, a das americanas Pfizer e BioNTech, além da vacina da Janssen-Cilag (Jhonson & Jhonson). Até agora, segundo Mendes, nenhuma empresa requisitou a autorização emergencial. "Quando recebermos o pedido poderemos dizer quanto tempo será preciso para fazer essa análise", disse ele.
O Reino Unido foi o primeiro país a autorizar, nesta quarta-feira, 2, o uso da vacina da Pfizer, desenvolvida em parceria com a BioNTech. A expectativa é entregar 800 mil doses à população já nas próximas semanas. Segundo fontes da Anvisa, a nova forma de autorização emergencial da agência segue moldes internacionais, como o do país europeu.
O governo Jair Bolsonaro aposta na vacina de Oxford. A Fundação Oswaldo Cruz (Fiocruz), laboratório co vinculado ao Ministério da Saúde, trabalha para incorporar a tecnologia e produzir as próprias doses deste imunizante.
Já o governo de São Paulo, comandado por João Doria (PSDB), investe na vacina desenvolvida pela farmacêutica chinesa Sinovac em parceria com o Butantã, a Coronavac.
O gerente da Anvisa disse que será feita uma análise "criteriosa" sobre qual a população que pode ser vacinada de forma emergencial. Ele afirmou ainda que a duração do aval para uso emergencial "depende do andamento dos estudos, pedido de registro e vai durar enquanto houver situação de emergência".
Mais cedo, em audiência pública no Congresso Nacional, o secretário-executivo do Ministério da Saúde, Elcio Franco, declarou que uma autorização provisória da Anvisa duraria apenas durante o período de calamidade pública pela covid-19, que se encerra no Brasil em 31 de dezembro deste ano, caso não seja prorrogada.
Vacinação no Brasil
Idosos com 75 anos ou mais, profissionais de saúde e indígenas serão os primeiros a ser vacinados contra a covid-19 no País, segundo cronograma apresentado na terça-feira, 1º, pelo Ministério da Saúde, em reunião com um comitê de especialistas.
No encontro, a pasta informou ainda que a perspectiva é começar a vacinação contra a doença em março de 2021 e finalizar a campanha somente em dezembro, quando há previsão de oferta de doses suficientes para imunizar a população-alvo. Não há previsão de vacinar toda a população no ano que vem, de acordo com a apresentação feita pelo ministério.


















